检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2016年11月23日,英国威廉希尔公司生命学院肖俊宇课题组在eLife杂志在线发表题为“Structure of protein O-mannose kinase reveals a unique active site architecture”的研究论文(DOI: http://dx.doi.org/10.7554/eLife.22238)。文章首次报道了蛋白质O连接甘露糖激酶POMK与底物分子结合的催化中间态晶体结构,发现POMK通过非典型的激酶骨架来催化反应,揭示POMK特异性识别底物的分子机制,并且阐述了POMK突变引发肌营养不良症的发病机制。
激酶磷酸化修饰生物大分子是诸多生理过程的重要环节。近年来新发现了 一系列分泌型激酶,参与调节许多重要的生理反应。POMK被报导能在内质网管腔内磷酸化α-Dystroglycan糖蛋白上的甘露糖残基,调控其后续糖链延伸。POMK的病变会引起α-Dystroglycan的功能异常,影响肌肉和脑的发育,造成先天性肌肉营养不良症(congenital muscular dystrophy)。然而POMK的催化机制悬而未决,序列比对发现它不具有典型激酶里高度保守的催化残基,因此长久以来它被认为是缺乏激酶活性“假激酶”(pseudokinase)。
为了研究POMK的作用机制,肖俊宇课题组通过结构生物学的手段,解析了POMK与三糖底物在催化中间态下的高分辨率晶体结构(2.0Å),揭示了一个前所未有的激酶活性位点。这个新型的激酶骨架由坐落在非典型位置上的催化残基构成,并被一对特殊的二硫键所稳定。底物分子GalNAc-β3-GlcNAc-β4-Man由POMK的一个表面凹槽所识别,而且相互作用主要发生在GalNAc-β3-GlcNAc部分。结合体内外生化和细胞实验,进一步验证了POMK行使功能的关键残基,同时阐明了诱发疾病的POMK突变是如何起作用的。这项工作不仅在原子层面上解释了POMK的作用机制,还进一步拓广了“假激酶”和新型分泌型激酶的研究。
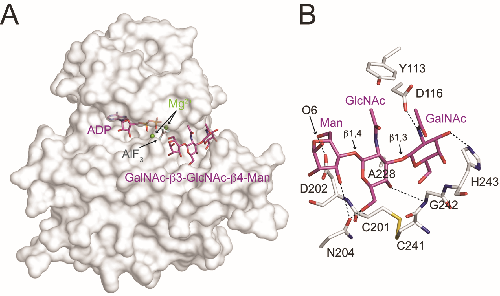
A. POMK和镁离子、ADP、AlF3和GalNAc-b3-GlcNAc-b4-Man三糖分子的复合体结构
B. POMK与GalNAc-b3-GlcNAc-b4-Man三糖分子的相互作用细节
北大-清华生命科学联合中心博士生朱秦毓(13级)是该论文的第一作者,生命学院肖俊宇研究员和爱荷华大学Roy J. and Lucille A. Carver医学院Kevin P Campbell教授是论文的共同通讯作者。北大-清华生命科学联合中心的陈兴研究员为共同作者。该项研究得到了国家自然科学基金、国家重点研发计划、蛋白质与植物基因研究国家重点实验室和北大-清华生命科学联合中心的支持。