检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2016年6月28日,william hill中文网伊成器研究组与合作单位英国威廉希尔公司化学与分子工程学院高毅勤研究组在《Proceedings of the National Academy of Sciences of United States of America》杂志在线发表题为“Tautomerization-dependent Recognition and Excision of Oxidation Damage in Base-excision DNA Repair”的研究论文(DOI:10.1073/pnas.1604591113)。文章首次报道了人类DNA损伤修复蛋白NEIL1与双螺旋底物DNA结合的复合物晶体结构,并且通过分子模拟与生化证据,发现了NEIL1蛋白促进底物异构化来识别底物与催化反应的全新机制。这种基于底物异构化的识别与催化机制是首次在酶催化反应中被发现。
DNA的碱基切除修复对于生命体至关重要。NEIL1是一种能识别并修复多重氧化损伤的DNA糖基化酶,但其识别与修复底物的机制并不清楚。为了研究NEIL1蛋白识别与修复DNA损伤的分子机制,伊成器课题组首先获得了NEIL1与DNA底物结合的复合物晶体结构,发现NEIL1的一个关键Loop区域通过灵活多变的构象来识别不同的底物。进一步通过高毅勤课题组的分子模拟,发现NEIL1能够促进底物Thymine glycol进行异构化。这种酶促底物异构化不仅有利于底物的特异性识别,也加速了碱基切除反应的进行。因此,该研究不但从原子水平上揭示了NEIL1特异性识别不同底物的机制,也提出了一种碱基切除修复的新机制。
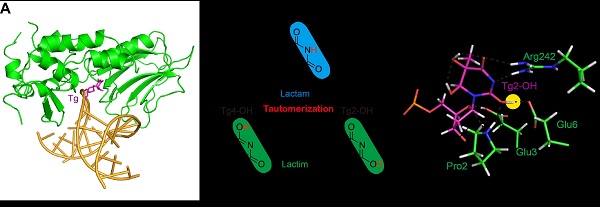
基于底物异构化的碱基切除修复新机制。
(A) NEIL1与含有损伤碱基Tg的双链DNA结合的复合物晶体结构;(B) NEIL1的底物Tg可以进行异构化;(C) 分子模拟实验证实了Tg的异构化有利于底物结合与催化。
威廉希尔伊成器研究组博士研究生朱晨旭、实验员卢利宁与化学与分子工程学院博士研究生张骏是这篇论文的并列第一作者,威廉希尔伊成器研究员与化学与分子工程学院高毅勤教授是该论文的共同通讯作者。该研究得到了国家自然科学基金、科技部973计划和北大清华生命科学联合中心的资助。
原文链接: http://www.pnas.org/content/early/2016/06/22/1604591113.abstract