检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
william hill中文网邓宏魁研究组和英国威廉希尔公司定量生物学中心汤超研究组合作,首次证明小鼠体细胞重编程可由调控分化的基因完成,并在此基础上提出细胞命运决定的“跷跷板模型”。2013年5月23日,该成果研究论文“Induction of pluripotency in mouse somatic cells with lineage specifiers”于《细胞》(Cell)期刊以封面文章形式在线发表。《细胞》同期还配发了希伯来大学Nissim Benvenisty教授对该工作的评论文章。
2006年,日本科学家Shinya Yamanaka发现向小鼠体细胞转入胚胎干细胞特异因子(OCT4, SOX2, KLF4, c-MYC)可以完成体细胞的重编程。在此之后,细胞重编程领域普遍认为向目标细胞状态的转变需要依赖于在目标细胞中特异高表达的因子的诱导。因此目前发现的能在细胞重编程中发挥作用的因子均在胚胎干细胞中高表达并且与细胞干性维持紧密相关。
传统观点认为分化因子与干性因子是相互拮抗、相互抑制的。干性基因在胚胎干细胞中高表达,抑制分化基因;分化基因在胚胎干细胞中不表达或低表达,高表达这些分化因子将抑制干性因子,破坏胚胎干细胞多能性的状态,导致其分化。
邓宏魁研究组通过大规模筛选发现,细胞重编程中至关重要的干性因子OCT4能够被调控中内胚层(ME)发育和分化的因子(如GATA3,GATA6,PAX1)代替;SOX2能够被调控外胚层(ECT)发育和分化的因子(如GMNN)代替。汤超研究组根据这一发现创新性地建立了“跷跷板模型”,该模型可更好地理解中胚层基因和外胚层基因在重编程过程中相互抑制和相互平衡的关系,这种关系可能决定了细胞命运的维持和改变。这一模型提供了诱导体细胞重编程的其它方法的预测,甚至还有一个出乎意料的模拟结果:如果同时过表达中内胚层和外胚层基因,就可以达到平衡从而同时替代SOX2和OCT4。进一步的实验结果也证实了这一可能,首次实现了用ME分化因子和ECT分化因子同时替代了细胞重编程过程中最关键的两个干性因子OCT4和SOX2。这一发现改变了向目标细胞状态的转变需要由在目标细胞中高表达的因子诱导的这一传统观点,为研究细胞命运转变提供了新视角,为理解细胞重编程和细胞命运决定的机制提供了新认识。
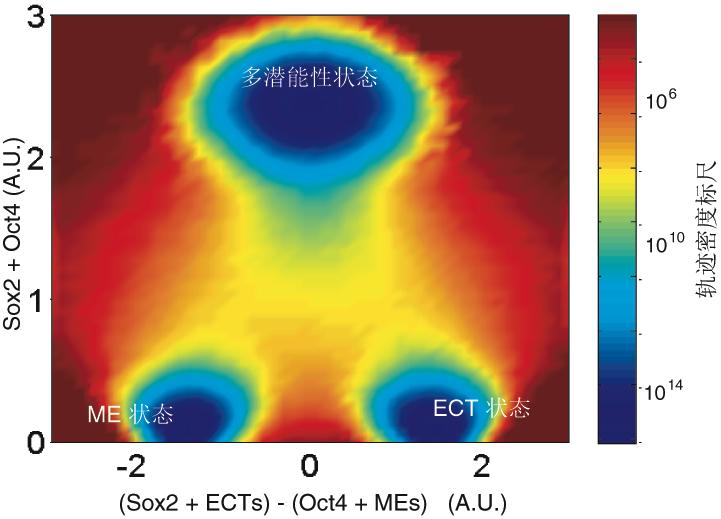
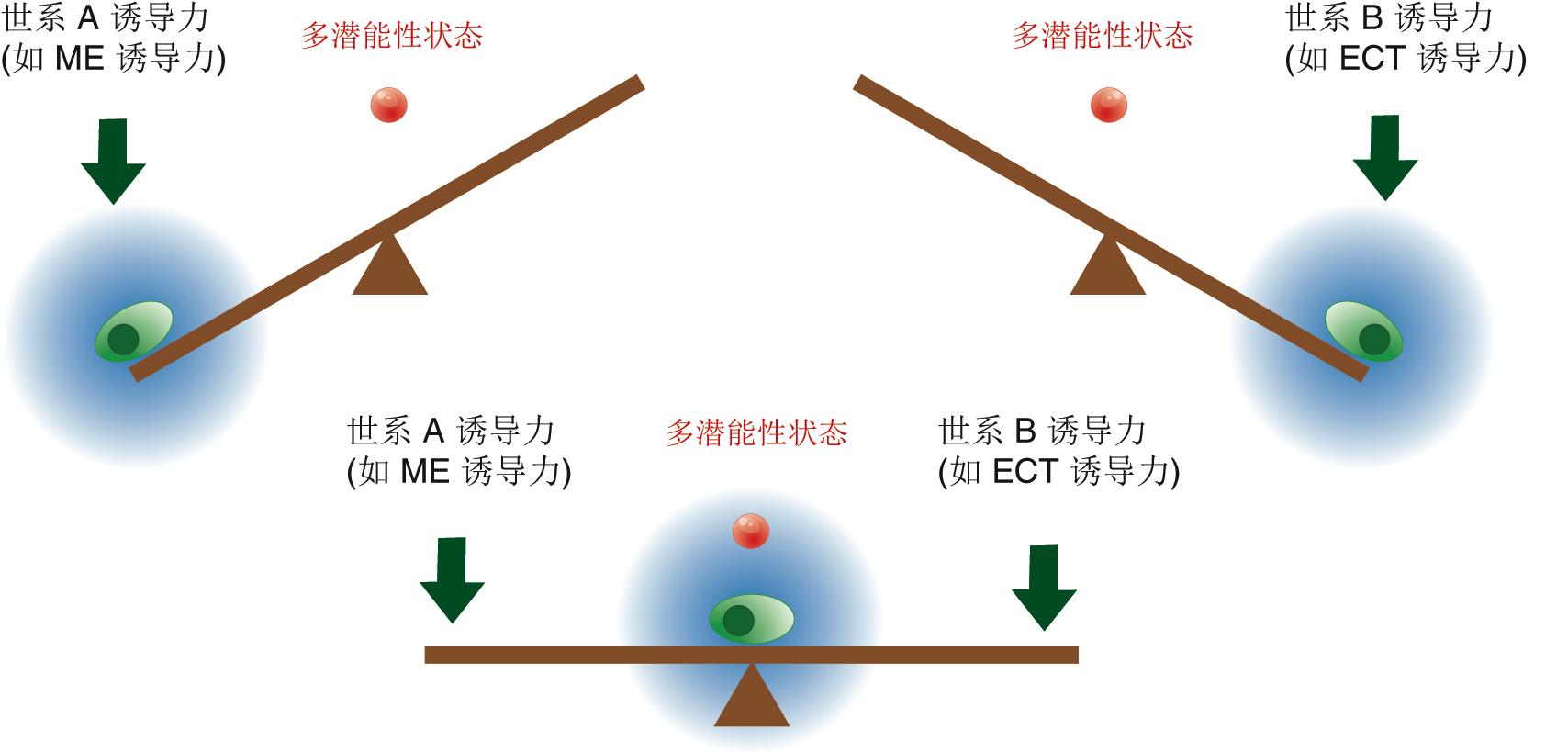
图2. 细胞命运决定的“跷跷板模型”